Acide Caproïque
L’acide caproïque, ou acide hexanoïque, est un acide gras saturé à six carbones, à l’odeur forte et fromagère, utilisé comme intermédiaire chimique, parfumant, ou agent attractif ou répulsif biologique.
Expédition
Dans toute l'Europe
Paiement sécurisé
CB, Virement, Paypal ...
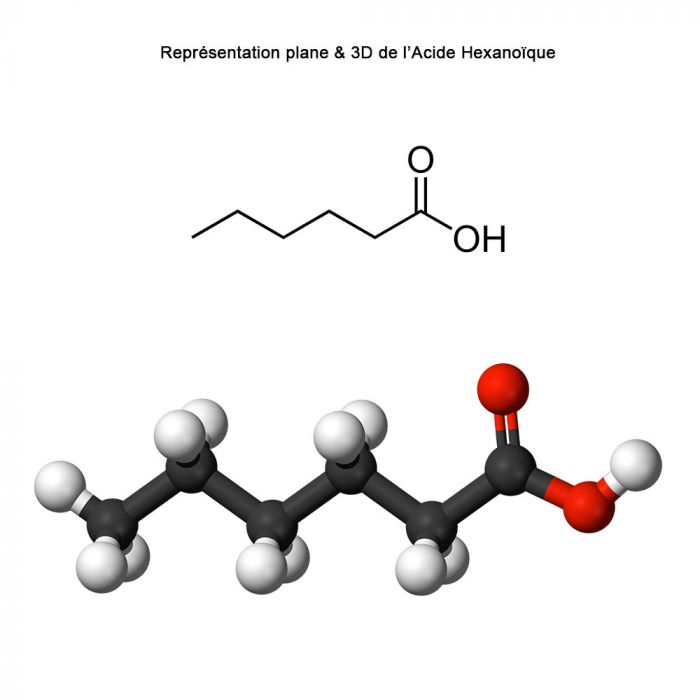
L’Acide Caproïque, également connu sous le nom d’Acide Hexanoïque, est un acide carboxylique saturé à six atomes de carbone, de formule chimique C₆H₁₂O₂. Ce composé organique appartient à la famille des acides gras à chaîne courte. Il se présente sous la forme d’un liquide huileux, incolore à légèrement jaunâtre, possédant une odeur forte, rappelant le bouc ou le fromage fermenté, d'où son nom issu du latin caper (chèvre).
Découvert au XIXe siècle dans des graisses animales, l'acide caproïque fut isolé pour la première fois dans des produits laitiers fermentés. Il est naturellement présent en petites quantités dans le lait de vache, l’huile de palme, le beurre et certaines huiles essentielles. Il joue un rôle physiologique modeste chez les ruminants et dans la flore intestinale humaine, notamment comme produit de fermentation.
Sur le plan physico-chimique, il possède un point d’ébullition de 205 °C et une solubilité modérée dans l’eau, bien qu’il soit miscible avec de nombreux solvants organiques. Il est acide (pKa ≈ 4,88) et présente une certaine réactivité typique des acides carboxyliques.
L’Acide Caproïque est fabriqué industriellement par oxydation du 1-hexanol ou par hydrolyse de l’hexanoate d’éthyle, lui-même issu d’estérification. Il peut également être obtenu par fermentation microbienne de substrats riches en matières organiques, comme les résidus agricoles, ce qui constitue une voie de production plus durable.
Il est utilisé principalement comme intermédiaire chimique dans la fabrication d’esters (pour les parfums et arômes), de lubrifiants, de plastifiants ou de solvants. Dans l’agroalimentaire, ses sels (hexanoates) sont employés comme additifs aromatisants, bien que son usage reste limité en raison de son odeur puissante. En biotechnologie, il est à l’étude comme précurseur de biocarburants.
Chimiquement, il peut subir des réactions classiques d’esterification, de réduction en alcool (hexanol), ou encore de halogénation sur la chaîne aliphatique. Il peut également entrer dans des condensations de type Claisen.
Ainsi, l’Acide Caproïque est un composé modeste mais polyvalent, au croisement de la chimie organique, des bioprocédés et de l’industrie des arômes.
Principales utilisations
Industrie chimique
- Fabrication d’esters hexanoïques
→ Utilisés comme solvants, plastifiants ou additifs parfumés.
Exemple : l’hexanoate d’éthyle, au parfum fruité, est utilisé dans les arômes. - Production de lubrifiants synthétiques
→ L’acide caproïque entre dans la formulation d’esters lubrifiants pour moteurs et compresseurs, notamment dans les systèmes à haute température. - Précurseur de composés spéciaux
→ Sert à produire des surfactants, des polymères biodégradables, ou encore certains agents de traitement pour les textiles et cuirs.
Industrie agroalimentaire
- Additif aromatisant (E-hexanoates)
→ Ses esters donnent une note fruitée ou fromagère : utilisés à très faibles doses dans les bonbons, les chewing-gums ou les produits laitiers. - Agent de fermentation
→ Présent naturellement dans des produits fermentés (fromages, lait), il est aussi étudié pour ses effets sur la flore microbienne.
Cosmétique et parfumerie
- Composant parfumant
→ Malgré son odeur désagréable à forte concentration, ses dérivés estérifiés entrent dans des parfums aux notes animales ou fruitées. - Matériau de base pour huiles et crèmes
→ Certains dérivés sont incorporés dans des formulations hydratantes ou texturisantes.
Applications émergentes et biotechnologiques
- Production de biocarburants
→ Par fermentation de déchets organiques, il peut être converti en alcools ou hydrocarbures utilisables comme carburants. - Rôle antimicrobien (recherches en cours)
→ Son activité contre certaines bactéries est explorée en médecine vétérinaire ou en conservation alimentaire.
En résumé, l’Acide Caproïque est un intermédiaire chimique polyvalent, prisé pour sa capacité à être transformé en produits à haute valeur ajoutée dans des secteurs variés.
Caractéristiques
- Formule brute : C₆H₁₂O₂
- Origine : France
- Pureté : 99% min
- Numéro Cas : 142-62-1
- Numéro CE : 205‑550‑7
- Numéro UN : 2829
- Dénomination INCI : Caproic Acid
Synonymes (liste non exhaustive)
Acide hexanoïque, acide n-hexanoïque, acide butylacétique, acide carboxylique à 6 carbones
Conseils d'emploi
L'association acide caproïque, bicarbonate d'ammonium et acide lactique est inspirée de la composition chimique des effluves humains (sueur, respiration), que certains moustiques utilisent pour nous localiser. Utilisée judicieusement, cette combinaison peut attirer ou détourner les moustiques, en perturbant leurs récepteurs olfactifs — selon les dosages et la formulation.
Voici un conseil d'emploi pour créer un piège passif qui attire les moustiques en imitant l’odeur corporelle humaine (CO₂ + acides organiques), les piège physiquement, puis les empêche de ressortir. :
Ingrédients et rôles
- Acide caproïque : imitation d’odeur corporelle → répulsif/leurre selon usage
- Acide lactique : imitation de sueur humaine (attractant ou perturbateur)
- Bicarbonate d’ammonium : source lente d’ammoniac → perturbe les récepteurs olfactifs des moustiques
- Sucre ou mélasse : nourriture pour fermentation légère.
Préparation d'un leurre répulsif passif (pot diffuseur)
Matériel :
- 1 bouteille en plastique vide (1,5 L), coupée au 2/3
- Ruban adhésif noir ou papier aluminium
- Coton ou papier absorbant
- Ficelle ou grillage fin (optionnel)
- Entonnoir inversé (partie haute de la bouteille)
Dosages pour 1 diffuseur :
- 0,5 ml d’acide caproïque
- 2 g de bicarbonate d’ammonium
- 1 ml d’acide lactique
- 200 ml d’eau distillée
- 10 à 20g de sucre
Instructions
- Mélanger tous les ingrédients dans le fond de la bouteille.
- Ajouter un disque de coton imbibé pour stabiliser l'évaporation des acides.
- Placer la partie supérieure de la bouteille à l’envers comme un entonnoir (ou couvercle percé).
- Envelopper le piège avec du papier noir ou le placer à l’ombre (les moustiques aiment les zones sombres).
- Laisser agir : les moustiques seront attirés par l’odeur, entreront dans le piège, et auront du mal à ressortir.
Conseils d’utilisation
- Placez le piège près des fenêtres, sous les lits, ou en extérieur à l’ombre.
- Changer la solution tous les 3–5 jours.
- Utiliser plusieurs pièges pour les grandes pièces.
- Portez gants, lunettes et blouse (acides et composés volatils).
- Travaillez dans un endroit bien ventilé.
- Ne pas appliquer cette formule sur la peau – usage en diffusion uniquement.
- Ne pas chauffer ou mélanger directement les acides avec de l’ammoniac pur.
- Ne pas ingérer ni inhaler directement.
- Ne pas appliquer sur la peau ou les animaux.
| Pictogramme(s) | Danger   |
| Phrase(s) de Risque | H314 : Provoque de graves brûlures de la peau et de graves lésions des yeux |
| Conseil(s) de Sécurité | P280 : Porter des gants de protection/vêtements de protection/équipement de protection des yeux/du visage |
| Pays de fabrication | France |
|---|---|
| Numéro CE | 205-550-7 |
| Numéro Cas | 142-62-1 |
| Numéro UN | 2829 |
| Code Douanier | 29159030 |
Chimiques
| Caractéristiques | Spécifications |
| Iodine Value (gl2/100g) | 1 max |
| Acide Value (mg KOH /g) | 475 - 482 |
| Saponification Value (mg KOH/g) | 476 - 483 |
| C6 | 99% min |
Physiques
| Caractéristiques | Spécifications |
| Aspect | Liquide jaunâtre |
| Odeur | Désagréable |
| Point de Fusion | Environ -4°C |
| Point initial d'ébullition | 203°C |
| Point d'éclair | 104°C |
| Inflammabilité | La substance n'est pas inflammable |
| Température d'inflammation | 380°C |
| Propriétés explosives | Le produit n'est pas explosif |
| Pression de vapeur à 25°C | ≤0,058 hPa |
| Densité à 20°C | 0,93 g/cm3 |
| Solubilité dans l'eau | 10,3 g/L |
| Coefficient de partage : n-octanol/eau à 25°C | 1,92 log Pow |
| Viscosité dynamique à 20°C | 3,2 mPas |